
produkt introduksjon
| Natriumfluorid Grunnleggende informasjon |
| Kjemiske egenskaper Løselighet i vann Bruksområder Påføring i tannkrem Produksjonsmetode Giftighetsfarer og sikkerhetsinformasjon |
| Produktnavn: | Natriumfluorid |
| Synonymer: | Alcoa sodium fluoride;Sodium fluoride puriss., meets analytical specification of Ph. Eur., BP, USP, 98.5-100.5% (calc. to the dried substance);Sodium fluoride ReagentPlus(R), >{{0}}%;NATRIUMFLUORID FOR ANALYSE EMSURE ACS,ISO,REAG. PH EUR;NATRIUMFLUORID INSEKTCELLEKULTUR*;Natriumfluorid, 99,995 % spormetaller unntatt K;Natriumfluorid, ACS, 99,0 % min.;Natriumfluorid, for analyse, 99+ % |
| CAS: | 7681-49-4 |
| MF: | FNa |
| MW: | 41.99 |
| EINECS: | 231-667-8 |
| Produktkategorier: | Krystallklasse uorganiske stoffer; metall- og keramikkvitenskap; analytisk/kromatografi; salter; natriumsalter; natriummetall- og keramikkvitenskap; røntgenkrystallografi; hjelpemidler for ISE; ionsensormaterialer; ledsagende produkter og reagenser; Syntetiske reagenser; insektsplattform; serumfrie medier; metallhalogenid;fluorid; syntetiske reagenser av ACS-kvalitet; essensielle kjemikalier; farmakopé (USP); farmakopé A-Z farmakopé (USP); farmakopeiske uorganiske stoffer; syntetiske reagenser; cytokjemiprodukter; hematologi og reagenser; optimering av reagenser Alfabetisk;applikasjon CRMs;F;FA - FL;ionekromatografi;ionekromatografistandarder;uorganiske kjemikalier;uorganiske;optimaliseringsreagenser;proteinstrukturanalyse;uorganiske salter;rutinereagenser;API;7681-49-4 |
| Mol fil: | 7681-49-4.mol |
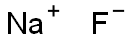 |
|
| Natriumfluorid Kjemiske egenskaper |
| Smeltepunkt | 993 grader (opplyst) |
| Kokepunkt | 1700 grader |
| tetthet | 1,02 g/ml ved 20 grader |
| damptrykk | 1,4 mm Hg ( 0 grader) |
| brytningsindeks | 1.336 |
| Fp | 1704 grader |
| lagringstemp. | 2-8 grad |
| løselighet | H2O: 0,5 M ved 20 grader , klar, fargeløs |
| form | pulver |
| farge | Hvit til off-white |
| Egenvekt | 2.558 |
| PH | 7.0-10.0 (25 grader, 0.5M i H2O) |
| Lukt | Luktfri |
| Vannløselighet | 4 g/100 ml (25 ºC) |
| Følsom | Hygroskopisk |
| Merck | 14,8618 |
| Eksponeringsgrenser | ACGIH: TWA 2,5 mg/m3 NIOSH: IDLH 250 mg/m3; TWA 2,5 mg/m3 |
| Stabilitet: | Stabil. Hydrolysert av vann. Reagerer med mineralsyrer for å generere svært giftig hydrogenfluorid. Ukompatibel med glass. |
| CAS-databasereferanse | 7681-49-4(CAS DataBase Reference) |
| NIST kjemireferanse | Natriumfluorid(7681-49-4) |
| EPA stoffregistersystem | Natriumfluorid (7681-49-4) |
| Sikkerhetsinformasjon |
| Farekoder | T,Xn |
| Risikoerklæringer | 25-32-36/38-22 |
| Sikkerhetserklæringer | 23-24/25-45-36-22 |
| OEB | B |
| OEL | TWA: 2,5 mg/m3 [*Merk: REL gjelder også andre uorganiske, faste fluorider (som F).] |
| RIDADR | UN 1690 6.1/PG 3 |
| WGK Tyskland | 1 |
| RTECS | WB0350000 |
| F | 10 |
| Merknad om fare | Giftig/Hygroskopisk |
| TSCA | Ja |
| HS-kode | 2826 19 10 |
| Fareklasse | 6.1 |
| Pakkegruppe | III |
| Data om farlige stoffer | 7681-49-4(data om farlige stoffer) |
| Giftighet | LD50 oralt hos rotter: 0,18 g/kg (Smyth) |
| HMS-datablad informasjon |
| Leverandør | Språk |
|---|---|
| SigmaAldrich | engelsk |
| ACROS | engelsk |
| ALFA | engelsk |
| Natriumfluorid bruk og syntese |
| Kjemiske egenskaper | Det er fargeløse krystaller eller skinnende hvitt pulver, tilhører det tetragonale systemet, er positive heksaedriske eller oktaedriske krystaller. Det er litt løselig i alkohol, løselig i vann. Vandig løsning er sur. Det oppløses i flussyre for å danne natriumhydrogenfluorid. |
| Løselighet i vann | Oppløst mengde per 100 ml vann ved forskjellige temperaturer (grader) i gram: 3,66g/0 grad ; 4,06g/20 grader ; 4,22g/30 grader ; 4,4g/40 grader 4,68g/60 grader ; 4,89 g/80 grader ; 5,08g/100 grader |
| Bruker | 1. Natriumfluorid brukes hovedsakelig som innlagt stål for mekanisk blad og høvel for å forbedre sveisestyrken. For det andre brukes det som trebeskyttelsesmidler, soppdrepende midler i bryggeriindustrien, landbrukssprøytemidler (bør være infisert med blått), medisinske konserveringsmidler, sveisemiddel, fluormiddel for drikkevann. Brukes også for produksjon av andre fluor- og kaseinlim, natriumfluorid-tannkrem, som lim, også brukt i papir- og metallurgisk industri. Ved produksjon av elementært fluor brukes det til å fjerne spormengder av hydrogenfluorid. I tillegg brukes den også i emaljer og farmasøytisk industri. 2. Natriumfluorid brukes som desinfeksjonsmidler, konserveringsmidler, plantevernmidler, også brukt i emalje, trebeskyttelse, medisin, metallurgi, produksjon av fluorider og så videre. 3. Brukes til bestemmelse av skandium i mikroanalyse, bestemmelse av fosfor i fotoelektrisk kolorimetrisk analyse, brukt som reagens, maskeringsmidlene, konserveringsmidler av jern og stål. 4. Som kosttilskudd. I henhold til kinesiske forskrifter for salt er maksimal bruk 0.1g/kg. 5. Det brukes som trebeskyttelsesmiddel, farmasøytisk konserveringsmiddel, sveisefluss og brukes i papirindustrien, dette selskapets produkter er tannkremer med spesifikke nivåer, kan også brukes som rensemiddel for drikkevann, og brukes til hud- og hudbehandling i garveindustrien, for smelting og raffinering av lettmetall, og beskyttelseslag av lettmetall, for limkorrosjon, og tilvirkning av kokende stål. 6. Natriumfluorid brukes som fosfatakselerator i beleggindustrien, gjør fosfatløsningsstabilitet, fosfatforfining, forbedrer ytelsen til fosfatbelegg. Aluminium og dets legeringer fosfat kan lukke negativ katalytisk Al3 + av stor fare, og gjøre fosfatering jevn. Det brukes som trebeskyttelsesmidler, landbrukssprøytemidler, soppdrepende midler i bryggeriindustrien, farmasøytisk konserveringsmiddel, sveiseflussmiddel, alkalisk sinkat sink tilsetningsstoffer og emalje, papir og så videre. |
| Påføring i tannkrem | Natriumfluorid ble tilsatt tannkrem som kan spille mot tannkaries, siden emalje interagerer med fluor for å danne fluorapatitt på emaljeoverflaten, noe som forbedrer emaljens hardhet og syrebestandighet, og reduserer dannelse av plakk, reduserer forekomsten av tannkaries. Fluortannkrem har noen anti-karieseffekter. Så tidlig som på midten av-19tallet tok gravide kvinner oralt kalsiumfluorid mot karies i Europa. I det 2.0 århundre er fluor anerkjent over hele verden som et effektivt middel mot karies. Vanligvis i fluortannkrem er innholdet av natriumfluorid 0.22-0,33 %, innholdet av natriummonofluorfosfat er 0,76 %. Selv om den er liten, har den en god beskyttende effekt på folks tenner, kan redusere kariesprevalensen på 28%. I henhold til forskjellig innhold av fluor i tannkrem, er fluortannkrem delt inn i følgende kategorier: natriumfluorid-tannkrem, monofluorfosfat-tannkrem, tinnfluorid-tannkrem, aminfluorid-tannkrem og så videre. For tiden er den vanligste fluortannkremen på markedet natriumfluorid-tannkrem og monofluorfosfat tannpleiemiddel, eller dobbel fluortannkrem som inneholder både natriumfluorid og natriummonofluorfosfat. Ulike typer fluortannkremer, og om tannkremene inneholder enkeltfluor eller doble fluorider, er effektene av anti-karies den samme. |
| Produksjonsmetode | Smeltedypningsmetode Kalsiner fluoritt, kvartssand og soda ved høy temperatur (800~900 grader), etterfulgt av vannutvasking, og deretter av fordampning, krystallisering, tørking for å forberede produkter. CaF2 + Na2CO3 + SiO2 → 2NaF + CaSi03 + C02 ↑ Nøytraliseringsprosess Det er avledet fra nøytralisering av soda eller kaustisk soda med flussyre, 2HF + Na2CO3 → 2NaF + H2O + CO2 ↑ Løs opp brus i gryten, og tilsett deretter 30 % flussyre for å nøytralisere til en pH-verdi på 8-9, inntil CO2-gassutvikling, flussyre inneholder ofte fluosilikatforurensninger, og etter nøytralisering for å generere natriumfluorsilikat, oppvarming i 1 time ved 90 ~ 95 grader brytes natriumfluorosilikat ned: Na2SiF6 + 2Na2CO3 → 6NaF + SiO2 + 2C02 ↑ Og under nøytraliseringsprosessen er pH-verdien ikke mindre enn 8, ellers er natriumfluorid vanskelig å dekomponere med base, og nøytraliseringsløsningen får stå i 1 time, serum avkjøles og konsentreres for å utfelle natriumfluoridkrystaller og separeres deretter ved sentrifugering , tørking, knusing for å få produkter. Natriumfluorosilikatmetoden Som biprodukt av den våte prosessen med fosforsyre og fosfatgjødsel, kan fluorkiselsyre fremstille 99,87 % natriumfluorid ved konvensjonelle metoder. Reaksjonen varer 160~180 minutter ved 84~95 grader og 0,15MPa forhold, med et overskudd på 5% til 8% alkalisk løsning (pH-verdi 8-9) for å fremstille natriumfluorid. Na2SiF6 + 2Na2Co3 → 6NaF + SiO2 + 2C02 ↑ Etter henstand og klaring av nøytraliseringsløsningen ble supernatanten konsentrert ved fordampning, avkjølende krystallisering, etter separering, vask med varmt vann på 50-60 grader, indirekte tørr for å oppnå produkter. |
| Giftighet | Natriumfluorid er et akutt giftstoff. Svelging av store mengder (5 til 10 g) kan forårsake død hos mennesker. Mindre mengder kan gi kvalme, oppkast, diaré, stupor og svakhet. Andre symptomer er skjelving, muskelsvakhet og dyspné. Sprekker av tenner kan oppstå ved kronisk eksponering. |
| Farer og sikkerhetsinformasjon | Kategori:Sprøytemiddel Toksisitetsgradering:Svært giftig Akutt toksisitet Oral-rotte LD50: 52 mg/kg; Oral-mus LD50: c57 mg/kg Stimulusdata Øyne-kanin 20 mg/24 timer moderat Brennbarhetsfareegenskaper:Den er ikke brennbar. I tilfelle av syre, frigjør det giftig hydrogenfluoridgass, oppvarming kan produsere giftige gasser av fluorid og natriumoksid. Lagringsegenskaper:Treasury ventilasjon lavtemperaturtørking, lagret separat fra oksidanter, mattilsetningsstoffer. Yrkesmessige standarder:TLV-TWA 2,5 mg (fluor)/kubikkmeter, STEL 5 mg (fluor)/kubikkmeter |
| Beskrivelse | Natriumfluorid, NaF, er et binært salt som er et klart, skinnende krystall eller hvitt pulver. Insektmiddelkvaliteten farges ofte blått. Det er løselig i vann og har en egenvekt på 2,558, som er tyngre enn vann. Natriumfluorid er svært giftig ved svelging og innånding, og er også sterkt irriterende for vev. TLV er 2,5 mg/m3 luft. Det firesifrede FN-identifikasjonsnummeret er 1690. De primære bruksområdene er fluorering av kommunalt vann ved 1 ppm, som insektmiddel, rodenticid og soppdreper, og i tannkremer og desinfeksjonsmidler. |
| Kjemiske egenskaper | Hvitt eller nesten hvitt pulver eller fargeløse krystaller. |
| Kjemiske egenskaper | Natriumfluorid er et hvitt pulver eller fargeløse krystaller. Brukes ofte i en løsning. Luktfri. Plantevernmiddelkvalitet farges ofte blått. |
| Fysiske egenskaper | Fargeløse kubiske eller tetragonale krystaller; tetthet 2,78 g/cm3; smelter ved 993 grader; fordamper ved 1695 grader; moderat løselig i vann 4,22 g/100 ml ved 18 grader; løselig i flussyre; uløselig i etanol. |
| Bruker | Natriumfluorid, dannet ved reaksjon av natriumkarbonat og flussyre, og deretter fordampet. Brukt (1) som et antiseptisk og antifermentativt middel i alkoholdestillerier, (2) som konserveringsmiddel for mat, (3) som gift for rotter og mort, (4) som en bestanddel av keramiske emaljer og flussmidler; natriumhydrogenfluorid, natriumdifluorid, natriumsyrefluorid, NaHF2, hvitt fast stoff, løselig, dannet ved reaksjon av natriumkarbonat og overskudd av flussyre, og deretter fordampning. Brukes (1) som et antiseptisk middel, (2) for etsing av glass, (3) som konserveringsmiddel for mat, (4) for konservering av zoologiske prøver. |
| Bruker | Natriumfluorid (NaF), i en konsentrasjon på én ppm, tilsettes kommunalt drikkevann for å redusere tannråte. Det brukes også som et insektmiddel, soppdreper og gnagermiddel, samt i produksjon av lim, desinfeksjonsmidler og tannprodukter. |
| Bruker | Som insektmiddel, spesielt for mort og maur; i andre plantevernmidler; bestanddel av glassaktig emalje og glassblandinger; som et stålavgassingsmiddel; i galvanisering; i flukser; i varmebehandlende saltblandinger; i fluoridering av drikkevann; for desinfisering av gjæringsapparater i bryggerier og destillerier; konservering av tre, pastaer og slim; produksjon av bestrøket papir; frosting glass; i fjerning av HF fra avgasser for å redusere luftforurensning. Dental karies profylaktisk. |
| Definisjon | ChEBI: Et metallfluoridsalt med et Na(+)-motion. |
| Preparat | Natriumfluorid fremstilles ved å tilsette natriumhydroksid eller natriumkarbonat til en 40 % løsning av flussyre. I overskudd av flussyre dannes natriumbifluorid, NaHF2. NaF er også laget ved fusjon av kryolitt med kaustisk soda. Produkter av teknisk kvalitet selges vanligvis med 90 til 95 % renhet. |
| Merkenavn | Fluorinse (Oral-B); Minute-Gel (Oral-B); Neutra Care (Oral-B); Pediaflor (Ross). |
| Generell beskrivelse | Natriumfluorid er et fargeløst krystallinsk fast eller hvitt pulver, eller det faste stoffet oppløst i en væske. Natriumfluorid dannes ved omsetning av natriumkarbonat og flussyre. Natriumfluorid er løselig i vann. Natriumfluorid er ikke brennbart. Natriumfluorid er etsende for aluminium. Natriumfluorid brukes som insektmiddel. Natriumfluorid brukes også til å fluorere vannforsyninger, som et trebeskyttelsesmiddel, i rengjøringsmidler, produksjon av glass og til mange andre bruksområder. |
| Fare | Giftig ved svelging og innånding, sterkt irriterende for vev. |
| Helsefare | Svelging kan forårsake oppkast, magesmerter, diaré, kramper, kollaps, tørste, forstyrret fargesyn, akutt giftig nefritt. |
| Helsefare | Den akutte toksisiteten til fluorider er generelt moderat. Høy eksponering kan forårsake irritasjon av øyne og luftveier. Inntak av fluor kan forårsake salt- eller såpesmak, oppkast, magesmerter, diaré, kortpustethet, talevansker, tørste, svak puls, forstyrret fargesyn, muskelsvakhet, kramper, bevissthetstap og død. Hos mennesker er den omtrentlige dødelige dosen av NaF ved inntak 5 g. Gjentatt innånding av fluorstøv kan forårsake overdreven forkalkning av beinet og forkalkning av leddbånd i ribbeina, bekkenet og ryggraden. Gjentatt hudkontakt kan forårsake utslett Fluorider har ikke vist seg å være kreftfremkallende eller å vise reproduksjons- eller utviklingstoksisitet hos mennesker. |
| Brannfare | Fluorer er ikke brennbare. |
| Brannfare | Ikke-brennbart, selve stoffet brenner ikke, men kan brytes ned ved oppvarming og produsere etsende og/eller giftige gasser. Noen er oksidasjonsmidler og kan antenne brennbare stoffer (tre, papir, olje, klær osv.). Kontakt med metaller kan utvikle brennbar hydrogengass. Beholdere kan eksplodere ved oppvarming. |
| Brennbarhet og eksplosjonsevne | Fluorer er ikke brennbare. |
| Industriell bruk | Natriumfluorid er et hvitt til gulaktig pulver, lite løselig i vann. NaF-løseligheten i vann er 3,85 % ved 15 grader og 4,21 % ved 25 grader. Kommersielt oppnås NaF ved å reagere flussyre med natriumhydroksid. Denne reaksjonen er et biprodukt under produksjonen av superfosfater fra fluorapatitt. Natriumfluorid er et viktig dempende middel som utelukkende brukes under bearbeiding av ikke-sulfidmineraler, så vel som de sjeldne jordartsmineralene som et dempende middel alene eller i kombinasjon med andre depressiva. Den brukes sammen med stivelse som meddepressant for rutil og ilmenitt under zirkonium-titan separasjon eller under omvendt silikatflotasjon fra rutil og ilmenitt med kationiske samlere. Selv om det antas at Na2F er et silikatdempende middel, studier har vist at det ikke deprimerer silikatmineraler. Faktisk forbedrer det depresjon av oksider og silikater når det brukes sammen med andre depressiva. |
| Biokjemiske/fysiologiske handlinger | Natriumfluorid (NaF) forhindrer karies ved å katalysere diffusjonen av kalsium og fosfat og remineraliserer lesjonene. Fluor påvirker spermatogenesen og kapasitasjonsprosessen i den kvinnelige forplantningskanalen. Fluor induserer oksidativt stress, DNA-skade i eggstokkene påvirker til slutt utviklingen av oocytter. Fluortilskudd øker beinmineraltettheten. 18F-NaF er en radiotracer som brukes i positronemisjonstomografi (PET) for å identifisere aterosklerotiske lesjoner og andre kardiale plakk. |
| Klinisk bruk | Natriumfluorid (NaF) fremmer spredning og aktivitet av osteoblaster og er klassifisert som et ikke-hormonelt beindannende middel. Fordi behandling med NaF induserer beindannelse, er det viktig at denne behandlingen kombineres med oral kalsiumtilskudd (1,000 mg/dag). I tillegg viser NaF moderat antiresorptiv aktivitet, fordi det hemmer osteoklastisk aktivitet når det absorberes i benmatrisen. Ved behandling av osteoporose er det terapeutiske vinduet for dette middelet ganske snevert: Doser mindre enn 45 mg/dag er subterapeutiske, og doser over 75 mg/dag svekker benmineralisering. I tillegg er beinet som dannes i nærvær av NaF verken så godt mineralisert eller så sterkt som normalt beinvev. Faktisk noen |
| Sikkerhetsprofil | Menneskelig gift ved inntak. Eksperimentell gift ved svelging, hudkontakt, intravenøs, intraperitoneal, subkutan og intramuskulær vei. Menneskelige systemiske effekter: endringer i tenner og støttestrukturer, cyanose, diaré, EKG-forandringer, væskeinntak, hodepine, hypermotihty, økt immunrespons, muskelsvakhet, muskel-skjelettforandringer, kvalme eller oppkast, parestesi, ptose (hengende øyelokk fra sympatisk innervasjon), respirasjonsdepresjon, endringer i spyttkjertel, skjelvinger. Eksperimentelle teratogene og reproduktive effekter. Human mutasjonsdata rapportert. Etsende irriterende på hud, øyne og slimhinner. Tvilsomt karsinogen med eksperimentelle tumorigene data. Det er veldig fytotoksisk. Ved oppvarming til nedbrytning avgir den giftige gasser av Fand NazO. Brukes i kjemisk rengjøring, for fluorering av drikkevann, som sopp- og insektmiddel. Se også FLUORER |
| Potensiell eksponering | Mye brukt i kjemisk industri; i vannbehandling og fluorering av drikkevann; som et insektmiddel, soppdreper og gnagermiddel; kjemisk rengjøring; galvanisering; glass produksjon; glassaktige emaljer; konserveringsmiddel for lim; tannkrem, desinfeksjonsmiddel, tannprofylakse; brukes også oralt i behandling av ulike beinsykdommer for å øke bentettheten og lindre bensmerter. |
| Frakt | UN1690 Natriumfluorid, Fareklasse: 6.1; Etiketter: 6.1-Giftige materialer. |
| Rensemetoder | Krystalliser NaF fra vann ved delvis fordampning i en vakuumeksikator, eller løs den i vann, og fell ut ca. halvparten av den ved å tilsette EtOH. Bunnfallet tørkes i luftovn ved 130o i ett døgn, og oppbevares deretter i ekssikkator over KOH. Løsligheten i H2O er 4 % ved 15o og 4,3 % ved 25o. [Kwasnik i Handbook of Preparative Inorganic Chemistry (Ed. Brauer) Academic Press Vol I p 235 1963]. |
| Inkompatibiliteter | Kontakt med syrer frigjør giftig gass. Uforenlig med oksidasjonsmidler (klorater, nitrater, peroksider, permanganater, perklorater, klor, brom, fluor, etc.); kontakt kan forårsake brann eller eksplosjoner. Holdes unna alkaliske materialer, sterke baser, sterke syrer, oksosyrer, epoksider. |
| Avfallshåndtering | I samsvar med 40CFR165, følg anbefalingene for avhending av plantevernmidler og plantevernmiddelbeholdere. Må kasseres på riktig måte ved å følge instruksjonene på pakningsetiketten eller ved å kontakte ditt lokale eller føderale miljøkontrollorgan, eller ved å kontakte ditt regionale EPA-kontor. |
| Natriumfluorid preparatprodukter og råvarer |
| Råvarer | Sodium hydroxide-->Sodium carbonate-->Hydrogen fluoride-->CARBON MONOXIDE-->Hexafluorosilicic acid-->Sodium fluorosilicate-->Calcium fluoride-->Fumed Silica-->phosphoric acid by wet process-->PHOS ROCK GJØDSEL I bulk |
| Forberedelsesprodukter | Sodium fluorosilicate-->3-Amino-2-fluoropyridine-->2-Fluoro-3-nitropyridine-->Sodium Monofluorophosphate-->Avfallsfjerner |
Populære tags: natriumfluorid, Kina natriumfluorid produsenter, leverandører, fabrikk
Et par: Natriumbromid
Neste: Tetraklorpropen
Du kommer kanskje også til å like
Sende bookingforespørsel







